政策加码,创新医疗器械迎机遇
近年来,在创新医疗器械领域,我国政府多次出台强有力政策,着重提高医疗器械的创新
能力和产业化水平,提供自主创新的沃土,多维度鼓励创新医疗器械,加快注册上市流程,
实现相关领域国产化,实现临床诊疗价格的下降,惠及于民。

整体来看,政策核心观点主要分为三部分:一是加快创新医疗器械审评审批,以“特别审批”和“优先审批”两大方向为核心,优化技术审评、行政审批等注册上市步骤,对部分具备核心技术发明专利、技术领先、临床急需等产品打开绿色通道,激发产业创新发展活力,促进医疗器械产业供给侧结构性改革,提高产业发展水平和国际竞争力;
二是重点发展具备重大临床价值产品,提高医疗服务质量和水平,加大具备重大临床价值医疗器械的投入力度,降低重大疾病的死亡率,提升患者生活质量,重点发展产品包括影像设备、医用机器人、植介入医疗器械、基因检测、新型生物医用材料、可穿戴设备、基层适宜的诊疗设备等;
三是突破自主创新,加速国产化,加强自主创新研发,突破一批进口垄断技术,提高医疗
器械国产占有率,实现从“模仿”到“引领”的跨越式发展,大幅降低患者诊疗费用。
审批加速,创新医疗器械可走“绿色通道”
根据政策安排,创新医疗器械可以通过特别审批通道获得上市。2017年,食品药品监管(CFDA)总局共收到创新医疗器械特别审批申请273项,完成323项审查(含2016年申请事项),确定63个产品进入创新医疗器械特别审批通道。批准注册分支型主动脉覆膜支架及输送系统等12个创新产品上市,具体如下图所示。

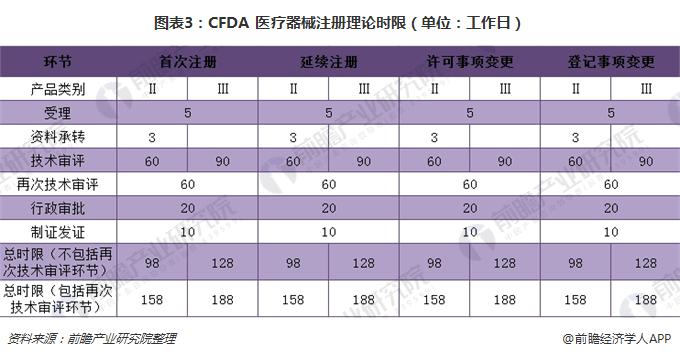
相比于传统审批流程,特别审批程序的审批时限较为缩短,例如正电子发射及X射线计算机断层成像装置从确定进入特别审批通道到最后获准上市仅花了5 个月的时间。而理论上,常规流程Ⅱ类医疗器械审批需要2 年左右的时间才能获得注册证,Ⅲ类需要3 年左右。未来随着经验积累和流程优化,审批时间有望进一步缩短。
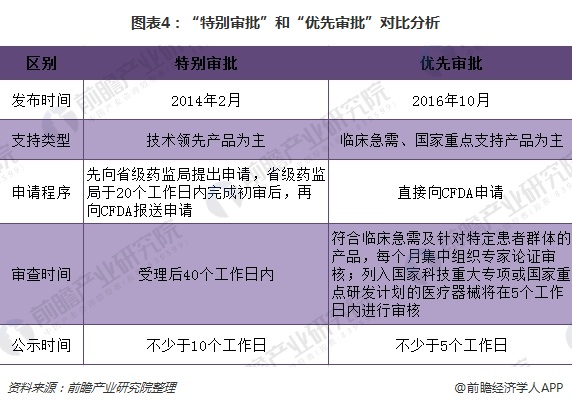
此外,2016 年10 月,CFDA 发布《医疗器械优先审批程序》,对于治疗罕见病、常见肿瘤、老年人特有和多发疾病、儿童和临床急需的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批。
优先审批是基于特别审批的基础上进一步完善细则,从制度要求对比上,优先审批范围进一步扩大,申请程序更简单便捷,审查周期更短,有利于为创新医疗器械审评审批提速提质。
创新医疗器械加速发展,应从何处着手?
可以预见,在政策推动下,我国创新医疗器械将迎来加速发展。那么,该如何把握住历史性发展机遇?
首先,要知道创新医疗器械申请未被批准的原因所在。目前,创新医疗器械申请未被批准主要有五个原因:一是不属于创新或成果转化;二是不能提供申请产品国际领先水平的资料;三是不能提供具显著性临床价值的支持资料;四是产品效益不高;五是
鉴于以上问题,我国创新医疗器械可以从四个方面着手:一是从医院和临床医生的需求着手,深入医院向临床医师多请教,寻求创新思想;二是从病人的需求着手,了解患者的实际需求,寻求创新突破点;三是从主要进口医疗器械的研究着手,凡是进口数量大、在国内占有市场优势的进口产品,往往都存在创新替代的机会;四是有关科研机构和高等院校入手,这些研究机构普遍存在创新医疗器械的转化机会。
以上数据来源参考前瞻产业研究院发布的《2018-2023年中国高值医疗器械行业市场需求预测与投资战略规划分析报告》。
 相关文章
相关文章



 精彩导读
精彩导读






 热门资讯
热门资讯
